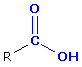
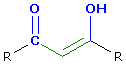
Carbonsäuren
Definition
- Verbindungen, die mindestens eine Carboxyl-Gruppe (-COOH) enthalten
Bemerkungen
- Die Acidität ist abhängig von sterischen und mesomeren Einflüssen des Restes, von Substituenten, etc. (RT 2-111)
- Carbonsäuren können mit sich selbst und polaren anderen Stoffen (z.B. Wasser als Lösemittel) Wasserstoffbrücken ausbilden
- Carbonsäuren sind brennbar!
- Gesättigte Carbonsäuren enthalten im Alkylrest nur Einfachbindungen, ungesättigte mindestens eine Mehrfachbindung.
- Bei vinylogen Carbonsäuren befindet sich mindestens eine weitere Doppelbindung zwischen der Carbonylgruppe und der Hydroxylgruppe der Säure, bei phenylogen ein Benzolring.
- Carbonsäuren bis C9 sind flüssig, danach sind sie fest.
- Bis C3 riechen Carbonsäuren stechend, bis ca. C10 unangenehm. Längere Carbonsäuren sind wegen zu geringer Flüchtigkeit geruchlos.
Strukturmerkmale Bezeichnung Carbonsäure vinyloge Carbonsäure
Darstellung
- Halogenoform-Reaktion
- R-CO-CX3 --> R-COOH
- Direkte Einführung der Carboxylgruppe
- Reppe-Carbonylierung
- R-COOH
- Koch-Haaf-Carbonylierung
- R-CH2OH --> R-CH2-COOH
- Kolbe-Schmitt-Synthese
- Ar-O- --> HO-Ar-COOH
- Reppe-Carbonylierung
- Carbonsäuren durch Oxidation
- Oxidation primärer Alkohole oder Aldehyde
- Edukte:
- prim. Alkohol, Aldehyde
- Produkte:
- Carbonsäuren
- Reagenzien:
- H2O
- Kaliumdichromat in verd. Schwefelsäure
- Primäre Alkohole werden zuerst unter Abspaltung von Wasserstoff zum Aldehyd oxidiert, dieses dann weiter zur Carbonsäure
- RT 2-115
- Edukte:
- Oxidation von Seitenketten an Aromaten
- Edukte:
- Alkylierte Aromaten
- Produkte:
- Benzoesäure
- Reagenzien:
- KMnO4
- Längere Seitenketten werden nach dem ringständigen C-Atom abgespalten. Die Oxidation erfolgt radikalisch, weshalb Reste ohne benzylständiges H-Atom relativ beständig sind.
- RT 2-116
- Edukte:
- Oxidation von mehrkernigen Aromaten
- Aromatische Ringe werden nur unter scharfen Bedingungen angegriffen.
- Stehen für die Oxidation mehrere Ringe zur Verfügung so wird der elektronenreichere abgebaut, der andere bleibt erhalten
- RT 2-117
- Oxidation primärer Alkohole oder Aldehyde
- Trihalogenierung und Hydrolyse
- Nach der radikalischen dreifachen Chlorierung einer kernständigen Methylgruppe, stellt diese das Trichlorid der Orthoform einer aromatischen Carbonsäure dar. Diese geht durch saure Hydrolyse in die Carbonsäure über.
- RT 2-118
- Willgerodt-Kindler-Reaktion
- Ar-CO-CH3 --> Ar-CH2-COOH
- Oxidative Spaltung von Alkenen
- Ozonolyse
- RCH=CHR --> RCHO --> RCOOH
- Ozonolyse
- Oxidative Spaltung von Ketonen
- Die C=C-Doppelbindung der Enolform von Ketonen kann durch Salpetersäure u.a. gespalten werden, dabei entsteht aus Ringketonen meist ausschließlich die offenkettige Dicarbonsäuren
- RT 2-120
- Grignard-Reaktion und anschließende Wasserabspaltung überführt Cycloketone in substituierte Cycloalkene, die oxidativ in langkettige Oxosäuren gespalten werden können. Diese lassen sich nach Wolff-Kishner oder Clemmensen reduktiv in die gesättigten Carbonsäuren überführen.
- RT 2-120f
- Hydrolyse von Carbonsäurederivaten
- Hydrolyse von Estern
- Alkalische Hydrolyse (= "Verseifung")
- Edukte:
- Produkte:
- Carbonsäuresalze
- Alkohole
- Reagenzien:
- OH-
- Die alkalische Hydrolyse ist quantitativ, da die entstehende Säure durch Salzbildung quantitativ aus dem Gleichgewicht entfernt wird.
- Die OH--Ionen werden verbraucht, sind also kein Katalysator!
- RT 2-122
- Saure Hydrolyse von Estern primärer und sekundärer Alkohole
- Edukte:
- Produkte:
- Carbonsäuren
- Alkohole
- Reagenzien:
- H2O / H+
- Reine Gleichgewichtsreaktion!
- RT 2-123
- Saure Hydrolyse von Estern tertiärer Alkohole
- Edukte:
- Carbonsäureester tertiärer Alkohole
- Produkte:
- Reagenzien:
- H2O / H+
- Die saure Hydrolyse von Carbonsäureestern tertiärer Alkohole verläuft über ein Carbeniumion. Dies reagiert bevorzugt zum Alken weiter, nicht zum tertiären Alkohol.
- RT 2-123
- Edukte:
- Alkalische Hydrolyse (= "Verseifung")
- Hydrolyse von Amiden
- Edukte:
- Amide
- Produkte:
- Carbonsäuren
- Reagenzien:
- Säuren, Basen
- Amide können nach dem gleichen Mechanismus wie Ester hydrolysiert werden. Dies erfordert jedoch schärfere Bedingungen, so z.B. längeres Erhitzen unter Rückfluss mit starken Säuren oder Laugen.
- Sowohl die alkalische (durch Slzbildung der Carbonsäure), als auch die saure (durch Bildung von Ammoniumsalzen) Hydrolyse sind irreversibel.
- RT 2-124
- Edukte:
- Hydrolyse von Nitrilen
- Edukte:
- Nitrile
- Produkte:
- Carbonsäuren
- Reagenzien:
- konz. HCl
- Nitrile selbst sind schwer zu hydrolysieren. Meist werden sie deshalb durch mehrstündiges Kochen mit konz. HCl in primäre Amide überführt, die dann hydrolysiert werden.
- RT 2-124
- Edukte:
- Hydrolyse von Estern
- Carbonsäuren durch C-C-Verknüpfung
- Cyanidverknüpfung
- Kolbesche Nitrilsynthese
und anschließende Hydrolyse des Nitrils
- R-X --> R-CN --> R-CO-NH2 --> R-COOH
- Cyanhydrinsynthese
und anschließende Hydrolyse
- R-CHO --> R-CH(OH)(CN) --> R-CH(OH)(COOH)
- Strecker-Synthese und anschließende Hydrolyse
- R2CO --> H2N-CR2-CN --> H2N-CR2-COOH
- Michael-Addition
von CN-, danach Hydrolyse, anschließend Reduktion (z.B. nach Clemmensen)
- R-CO-CH=CH2 --> R-CO-CH2-CH2-CN --> R-CO-CH2-CH2-COOH --> R-CH2-CH2-CH2-COOH
- Kolbesche Nitrilsynthese
und anschließende Hydrolyse des Nitrils
- Acetoessigester-Synthesen
- RT 2-131
- Acylierung von Enaminen
mit anschließender Säurespaltung
- RT 2-133
- Cannizzaro-Reaktion
- 2 R-CHO --> R-COOH + R-CH2OH
- Claisensche-Esterkondensation, dann Hydrolyse und Reduktion
-
2 H3C-COOEt ----> H3C-CO-CH2-COOEt --> H3C-CO-CH2-COOH --> H3C-CH2-CH2-COOH
-
- Cyanethylierung
und anschließende Hydrolyse
- H2C=CH-CN + R2CH2 --> R2CH-CH2-CH2-CN --> R2CH-CH2-CH2-COOH
- Grignard-Reaktion
- R-MgI + CO2 --> RCOOH
- Knoevenagel-Reaktion
- Ar-CHO --> Ar-CH=CH-COOH
- Malonester-Synthesen
- RT 2-128
- Perkin-Reaktion
- Ar-CHO --> Ar-CH=CH-COOH
- Sandmeyer
mit CN- und anschließende Hydrolyse
- Ar-N2 --> Ar-CN --> Ar-COOH
- Cyanidverknüpfung
- Carbonsäuren durch Umlagerungen
- Arndt-Eistert-Reaktion
- R-COCl --> R-CH2-COOH
- Beckmann-Umlagerung
- RR'C=NOH --> RCO-NHR' --> RCOOH
- Benzilsäure-Umlagerung
- Ar-CO-CO-Ar --> Ar2COH-COOH
- Favorskii-Umlagerung
- R1CO-CXR2R3 --> HOOC-CR1R2R3
- Arndt-Eistert-Reaktion
Funktionelle Carbonsäurederivate
- Ester, Orthoester
- Amide, Hydrazide, Azide, Hydroxamsäuren
- Halogenide
- Säurehalogenide: Verbindungen in denen die OH-Gruppe der Carboxy-Gruppe durch ein Halogen ersetzt ist (COX)
- Anhydride u.a.
- Dicarbonsäuren, gesättigte und ungesättigte
- Substituierte Carbonsäuren
- Halogen-, Hydroxy-, Oxo-, Aminosäuren
- Derivate der Kohlensäure
- Verbindungen, die sich von der Kohlensäure H2CO3 ableiten