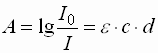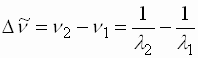UV-Vis-Spektroskopie
Definition
- Spektrometrisches Verfahren, das auf der stoffspezfischen Absorption von Lichtquanten bestimmter Energie beruht.
Messprinzip
- Elektromagnetische Strahlung mit Wellenlängen im Bereich des ultravioletten und sichtbaren Lichts wird teilweise von, v.a. organischen, Molekülen absorbiert.
- Dabei werden jedoch nur Lichtquanten mit den Energien absorbiert, die zu einer Anregung von p- und n-Elektronen führen können.
- Die Absorption folgt dem Lambert-Beerschen-Gesetz und ergibt sich zu:
A : Absorption I0 : Ausgangsintensität des Lichtstrahls I : Intensität des Lichtstrahls nach Durchlaufen der Probe e : molarer Extinktionskoeffizient c : molare Konzentration d : Schichtdicke
- Messtechnisch registriert wird nun die durch die Probe gelassene Lichtstrahlung bei einer, besser jedoch mehreren verschiedenen Wellenlängen. Daraus ergibt sich die Absorption und mit ihr entweder eine Information über die eingesetzte Stoffkonzentration (c), oder aber den Stoff selbst (ε).
Aufbau
- Im Einsatz sind sowohl Ein- als auch Zweistrahlgeräte.
- Bei den Einstrahlgeräten ist vor der eigentlichen Messung der Blindwert der benutzten Küvette mit dem reinen Lösemittel aufzunehmen. Bei Zweistrahlgeräten muss eine vergleichbare Küvette mit dem reinen Lösemittel in den Vergleichsweg gebracht werden.
- Die Qualität (und der Preis) der Geräte zeigt sich z.B. in der maximalen Auflösung des Geräts. Diese ist vor allem von der spektralen Bandbreite des Spektrometers abhängig. Diese gibt an, wie genau die gewählte Wellenlänge eingehalten wird. Eine hohe spektrale Bandbreite äußert sich somit in einer starken Streuung des eingestrahlten Wellenlängenbereichs und somit schlechter Signaltrennung.
Anwendungsgebiet
- Qualitative und quantitative Bestimmung vieler organischer Moleküle.
Verbotene Elektronenübergänge
- Nicht alle theoretisch nun denkbaren Elektronenübergänge kommen tatsächlich vor.
- Es gibt mehrere Übergangsverbote:
- Spin-Verbot (Interkombinationsverbot)
- Verbot des Übergangs von Singulett- in Triplett-Zustände und vice versa.
- Überlappungsverbot (Raumverbot)
- Verbot von Elektronenübergängen, bei welchen sich die beteiligten Orbitale nicht oder nicht genügend überlappen.
- Symmetrieverbot
- Verbot von Elektronenübergängen zwischen Elektronenzuständen gleicher Symmetrie.
- Spin-Verbot (Interkombinationsverbot)
- Für die UV-Spektroskopie von Bedeutung ist die Tatsache, dass diese Verbote unter bestimmten Bedingungen durchbrochen werden können und trotzdem Absorptionsbanden messbar sind (verbotene Übergänge). Allerdings sind ihre Signale meist nur geringer Intensität, da die Übergangswahrscheinlichkeit ebenfalls nur gering ist.
Aussehen der Absorptionsbanden
- Die Absorptionsbanden im UV-Vis-Spektrum sind durch ihre Lage (λmax), ihre Höhe (εmax) und ihre Form gekennzeichnet.
- Die Lage des Absorptionsmaximums (λmax) hängt von der Energie ab, die zur Anregung aus dem Grundzustand S0 in einen angeregten Zustand erforderlich ist.
- Im Falle erlaubter Übergänge ist eine UV-Vis-Bande umso intensiver (also die Übergangswahrscheinlichkeit aus dem Grund in den Anregungszustand umso größer), je leichter das Molekül mit der eingestrahlten Strahlung in Wechselwirkung treten kann.
- Dies ist umso besser möglich, je mehr sich die Ladungsverteilung im Molekül bei Elektronenübergängen ändert. Der Grund dafür liegt in der Tatsache, dass das elektromagnetische Wechselfeld des Lichts leichter an Moleküle angreifen kann, deren Ladungsverteilung zwischen den beteiligten Zuständen unterschiedlicher ist.
- Die Intensitätserhöhung einer Bande wird als hyperchromer Effekt bezeichnet, eine Abschwächung als hypochromer Effekt. Diese Effekte sind nicht mit bathochrom und hypsochrom zu verwechseln!
- Die Breite der Absorptionsbanden hängt von der Lebensdauer der Anregungszustände ab.
- Sie werden mit abnehmender Stabilität der Energieniveaus breiter.
- Ebenso steigt die Bandenbreite mit zunehmender Wechselwirkung der Substanz mit dem Lösungsmittel, was mit der erleichterten Energieabgabe erklärt werden kann. Daher erhält man bei der Untersuchung von Molekülen im Gaszustand schmale Banden, in unpolaren Lösungsmitteln etwas breitere und in polaren Lösungsmitteln relativ breite. Dieser Effekt betrifft vor allem die für das Lösungsmittel leichter zugänglichen n-Orbitale.
Franck-Cordon-Prinzip
- ...
Auswertung
- Absolutmethode
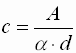
c : Konzentration A : gemessene Absorption a : molarer Absorptionskoeffizient d : Schichtdicke - Da α sowohl von der Temperatur, als auch von der Frequenz abhängig ist, ergibt sich eine gewisse Ungenauigkeit. Diese entsteht dadurch, dass eine genaue Punktmessung bei nur einer Frequenz nicht möglich ist. Vielmehr wird die Absorption in einem Wellenlängenbereich gemessen, dessen Breite von der Qualität des Spektrometers abhängt. Je besser das Gerät ist, desto kleiner ist der Messbereich.
- Externer Standard
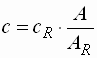
c : Konzentration cR : Konzentration der Referenzlösung A : gemessene Absorption AR : Absorption der Referenzlösung - Es erfolgen mehrere Messungen nacheinander. So werden Fehlerquellen im Gerät und im anderen Messablauf minimiert.
- Zur Ermittlung der notwendigen Kalibriergerade sollten Punkte in der Nähe der (anzunehmenden) Konzentration der Probe verwendet werden, da der angenommene lineare Zusammenhang nur für kleine Konzentrationsdifferenzen gilt.
Leistungsbewertung
- Hohe Präzision (relsdv ca. 1 %)
- Gute Robustheit
- Hohe Empfindlichkeit, abhängig vom molaren Absorptionskoeffizienten α
- Geringe wellenlängenabhängige Selektivität
Chromophore aus π -Elektronen
- Chromophore Systeme aus π-Elektronen weisen Alkene, Alkine und aromatische Verbindungen auf.
Alkene, Polyene
- Der π-π*-Übergang des Ethens weist eine Absorption bei 162 nm, also im Bereich des Vakuum-UV-Lichtes auf.
- Mit zunehmender Zahl konjugierter Doppelbindungen verschiebt sich das Absorptionsmaximum zu höheren Wellenlängen (Rotverschiebung).
- Ursache ist die zunehmende Erhöhung des höchsten besetzten Orbitals (HOMO) und gleichzeitig die Erniedrigung des untersten leeren π-Orbitals (LUMO). Aus diesem Grund wird die zur Anregung erforderliche Energiedifferenz ΔE immer kleiner, die Wellenlänge des absorbierten Lichts also größer.
- β-Carotin enthält 11 konjugierte Doppelbindungen, die zu einem Absorptionsmaximum bei 451 nm (blau) führen, weshalb die Substanz orange erscheint.
Quadratwurzelgesetz
- R. Kuhn und K.W. Hausser fanden einen Zusammenhang zwischen der Lage des längstwelligen Absorptionsmaximums und der der Anzahl der konjugierten Doppelbindungen bei konjugierten Polyenen. Danach gilt:
lmax : Wellenlänge des Absorptionsmaximums n : Anzahl konjugierter Doppelbindungen
- Diese Formel liefert recht gute Annäherungen an den tatsächlichen Messwert für das Absorptionsmaximum.
- Durch Einsetzen eines Messwertes lässt sich mit Hilfe dieser Formel auch auf die Anzahl der konjugierten Doppelbindungen im Molekül zurückschließen.
Dien-Regel
- Bei ungesättigten Steroiden und anderen Polyenen kann zur Abschätzung des Absorptionsmaximums die Dien-Regel nach R. B. Woodward eingesetzt werden.
- Sie beruht auf einem empirisch ermittelten Inkrement-System.
- Zur Berechnung werden zu einem Grundwert bestimmte Werte für einzelne Strukturelemente addiert.
- Die Lage und Intensität des längswelligen Absorptionsmaximums wird auch von der geometrischen Konfiguration beeinflusst.
- Oftmals absorbieren cis-Isomeren kürzerwellig und weniger intensiv als trans-Isomeren. So zeigen cis-Carotine einen charakteristischen Peak bei ca. 340 nm, den die trans-Formen nicht
- aufweisen.
Substituenteneinflüsse auf Polyenchromophore
- Durch Substitution am chromophoren System eines Polyens kommt es zu einer Verschiebung des Absorptionsmaximums in den längerwelligen Bereich.
- Zur Bewertung der Stärke dieses Einflusses bei bestimmten Substituenten, setzt man
- den Wert, den eine zusätzliche konjugierte Doppelbindung haben würde gleich Eins.
- Der Einfluss des Substituenten ergibt sich nun als Bruchteil oder
Vielfaches diese festgesetzten Vergleichswertes.
Substituent Einfluss [Doppelbindungen] Alkylgruppe 0,1 - 0,3 Benzolring 1,6 - 2,8 Hydroxylgruppe 0,1 Carboxylgruppe 0,4 - 1,1 Carbonylgruppe 0,6 - 1,5
Alkine
- Das Absorptionsverhalten von Alkinen entspricht weitgehend dem der Alkene.
- Unterschiede ergeben sich jedoch z.B. für das Quadratwurzelgesetz, das nun folgendermaßen lautet:
lmax : Wellenlänge des Absorptionsmaximums n : Anzahl konjugierter Doppelbindungen
- Die Absorptionsbanden der Polyine zeigen oftmals eine stärker ausgeprägte Feinstruktur, als die der Polyene.
Aromaten
- Benzol zeigt drei, sehr unterschiedlich ausgeprägte, Absorptionsbanden, die alle π-π*-Übergängen entsprechen.
- Die längstwellige, feinstrukturierte Bande wird oftmals allein zur Auswertung herangezogen. Bei Messungen von Benzoldämpfen ist sie besonders ausgeprägt.
Monosubstituierte und disubstituierte Benzolderivate
- Alkylbenzole zeigen ähnliche Spektren wie unsubstituiertes Benzol.
- Substituenten mit n- oder π-Elektronen in Konjugation zum aromatischen System führen zu einer bathochromen Verschiebung aller Banden, einer Erhöhung der Intensität und meist zum Verlust der Feinstruktur.
- Bei stärkerer bathochromer Verschiebung kann die B-Bande (Benzol: 255 nm, e = 230) durch die in ihrer Intensität erhöhte E-Bande (Benzol: 198 nm, e = 8000) überholt werden. Die E-Bande wird nun als K-Bande bezeichnet. Die B-Bande liegt nun meist zwischen 250 und 290 nm (e = 200 - 2000), die K-Bande bei 200 - 250 nm (e = 7000 - 15000).
- In der folgenden Tabelle finden sich die Wellenlängen der Absorptionsmaxima einiger mono- bzw. disubsubstituierter Benzolringe.
R1 R2 lmax [nm] -H -H 254 -NH3+ -H 254 -OH -H 270 -NH2 -H 280 -O- -H 287 -OH -NO2 318 -NH2 -NO2 381 -O- -NO2 403
Phenole
- Liegen im Phenol keine zusätzlichen chromophoren Substituenten vor, so befinden sich die Absorptionsmaxima bei ca. 210 nm (e = 6200) und 270 nm (e = 1450) mit einer Schulter bei ca. 285 nm.
- ....
Phenolether
- Phenolether zeigen ähnlich wie Phenole zwei Maxima bei ca. 270 - 290 nm (e = 2000) und 270 - 280 nm (e = ca. 2000), zusätzlich kann eine E-Bande bei 220 - 230 nm vorliegen.
Aromatische Carbonsäuren
- Aromatische Carbonsäuren weisen zwei Maxima auf; bei ca. 273 nm (e = 1000) und ca. 225 nm (e = 12000).
Aromatische Amine
- Primäre, sekundäre und tertiäre aromatische Amine zeigen ein Absorptionsmaximum bei ca. 290 nm (e = 2000), welches durch zusätzliche funktionelle Gruppen zu höheren Wellenlängen verschoben wird.
Polycyclische Aromaten
- Die Absorptionsmaxima anellierter aromatischer Systeme können so weit verschoben sein, dass sie bereits im sichtbaren Bereich liegen. Außerdem erhöht sich der Betrag der Absorption.
- Auch bei den polycyclischen Aromaten kann die B-Bande von der E-Bande überholt werden (z.B. beim Übergang von Naphtalin / Anthracen).
Unterscheidung von Polyenen, Polyinen und Aromaten
- Durch Berechnung der Wellenzahldifferenzen
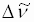 der Teilbanden der feinstrukturierten Spektren können Polyene, Polyine und Aromaten voneinander
relativ sicher unterschieden werden.
der Teilbanden der feinstrukturierten Spektren können Polyene, Polyine und Aromaten voneinander
relativ sicher unterschieden werden.
: Differenz der Wellenzahl λ1, λ2 : Wellenlängen der Teilbanden n1, n2 : Wellenzahlen der Teilbanden
- Die Wellenzahldifferenz beträgt für Polyene ca. 1500 cm-1, für Polyine ca. 2000 cm-1 und für Aromaten ca. 700 - 1100 cm-1.
UV-Vis-Spektroskopie nach vorangegangener Derivatisierung
- Durch Einführung chromophorer Systeme wird erreicht, dass vorher nicht bestimmbare Verbindungen nun doch vermessen werden können.
Verfahren
- Farbstoff-Ionenpaar-Extraktion
- Geladene Moleküle werden mit einem Farbstoff entgegengesetzter Ladung umgesetzt.
- So werden z.B. Moleküle, die ein kationisches Zentrum aufweisen, mit anionischen Farbstoffen wie Methylorange oder Bromphenolblau zu Ionenpaaren umgesetzt.
- Die entstandenen Ionenpaare sind elektrisch nach außen neutral und können in ein organisches Lösemittel extrahiert werden.
- Es findet eine quantitative Umsetzung statt.
- Hydroxamsäurereaktion
- Primär für Carbonsäureester und Säurehalogenide. Andere Derivate von Carbonsäuren müssen zuerst in bestimmbare überführt werden.
- Die aus dem Carbonsäurederivat und Hydroxylamin gebildeten Hydroxamsäuren bilden mit Eisen(III) bei pH-Werten um 4 einen rot-violetten Komplex.
- Komplexbildung mit Fe3+
- Nur für Phenole
- Diazotierung
- Bei aromatischen Aminen.
- Die Diazotierung verläuft beim Einsatz von Bratton-Marshall-Reagenz (N-(1-Naphtyl-)ethylendiamin) vollständig.
Leistungsbewertung
- Höhere Selektivität als ohne Derivatisierung, da die Derivatisierung selbst bereits selektiv ist und zusätzlich bei höheren Wellenlängen gemessen werden kann
- Verbesserte Empfindlichkeit
- Schlechtere Robustheit, da durch die Derivatisierung zusätzliche potentiell fehlerbehaftete Schritte notwendig sind