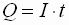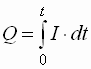Coulometrie
Definition
- Elektrochemisches Bestimmungsverfahren
beruhend auf der Messung der Ladungsmenge während der vollständigen elektrochemischen Umsetzung des Analyten.
Bemerkungen
- Es sind sehr kleine Mengen exakt bestimmbar.
-
Bei der Durchführung
coulometrischer Titrationen ist darauf zu achten, dass die Lösung
eine ausreichende elektrische Leitfähigkeit besitzt. Dies wird z.
B. durch Zugabe eines Leitelektrolyten erreicht.
-
Außerdem muss
eine intensive Durchmischung der Analysenlösung mit dem
Titrationsmittel erfolgen.
-
Coulometrische
Titrationen lassen sich besonders bei Mikrobestimmungen sehr
vorteilhaft einsetzen, da das Reagens Strom besonders genau
messbar und gut dosierbar ist.
-
Ein Vorzug ist
weiterhin, dass das eigentliche chemische Reagens durch den Strom
erst direkt im Reaktionsgefäß erzeugt
wird, und so "in statu nascendi" zur Reaktion kommen kann
(z.B. Brom). Dadurch sind Fehler durch Alterung praktisch
ausgeschlossen.
-
Der Äquivalenzpunkt
muss durch eine geeignete Methode indiziert werden, z.B. durch
Farbindikatoren oder mittels der Potentiometrie.
-
Bei der
potentiostatischen Coulometrie ist zudem eine direkte Endpunktsbestimmung
möglich.
Methoden
- Coulometrische Analysen können
nach zwei Methoden durchgeführt werden:
- galvanostatische Coulometrie
- Beim galvanostatischen
Verfahren wird mit konstanter Spannung gearbeitet.
- Da die Spannung zu jedem
Zeitpunkt der Bestimmung gleich ist, errechnet sich die verbrauchte Strommenge zu:
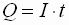
- potentiostatische
Coulometrie
- Bei der Coulometrie mit kontrolliertem
(konstantem) Potential sinkt die Spannung exponentiell zur Konzentration des Analyten.
- Da die Spannung nicht konstant ist, muss die verbrauchte Strommenge durch Integration der
Spannung über die Zeit der Reaktion berechnet werden:
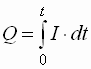
- Die Technik mit kontrolliertem,
konstantem Potential (mit Arbeits-, Bezugs- und Hilfselektrode)
ist selektiver als die mit konstanter Spannung.
Auswertung (potentiostatische Coulometrie)
- Da die Spannung exponentiell abfällt, wird der Äquivalenzpunkt nie wirklich erreicht. Dennoch kann man den Äquivalenzpunkt hinreichend genau interpolieren.
- Man setzt dazu einen bestimmten Spannungswert fest, der unterschritten werden muss. Liegt dieser bei 0,1 % des Anfangswertes, so sind an dieser Stelle 99,9 % des Analyten umgesetzt.
- Anhand der bis zu diesem Zeitpunkt
geflossenen Ladungen, kann mit Hilfe des zweiten
Faradayschen Gesetzes die umgesetzte Stoffmenge, bzw. deren
Masse berechnet werden.
Einsatzbereich
|