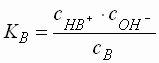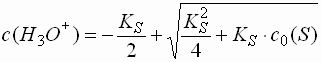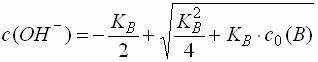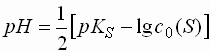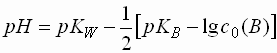Berechnung des pH-Werts
Übersicht
- Sehr starke und starke Protolyte bis pK ca. 1
- Starke Protolyte (pK 1 - 4,5)
- Schwache Protolyte (pK 4,5 - 9,5)
- Mehrwertige Protolyte
Sehr starke und starke Protolyte bis pK ca. 1
- Diese Protolyte liegen in Wasser praktisch
vollständig dissoziiert vor. Daher kann ihre Aktivität gleich der
Konzentration gesetzt werden. Der pH-Wert ergibt sich zu:
Einwertige Säuren
Einwertige Basen
- Der pH-Wert mehrwertiger Protolyte, deren pKS-Werte alle im Bereich bis ca. pK = 1 liegen, berechnet sich analog.
- Bei Konzentrationen des Protolyten unter 10-5 muss die Autoprotolyse des Wassers mit berücksichtigt werden!
Starke Protolyte (pK 1 - 4,5)
- Protolyte mit einer Säure- bzw. Basenstärke im Bereich zwischen ca. 1 und 4,5 liegen normalerweise in wässriger Lösung nicht mehr vollständig dissoziiert vor.
- Ein Teil der Säure liegt in der undissoziierten Form (HA), der Rest in der dissoziierten Form (H3O+ + A-) vor. Wegen der Elektroneutralitätsbeziehung, die aussagt, dass jede Lösung nach außen neutral sein muss, gilt, dass die Konzentration der dissoziierten Form der Säure (A-) gleich der Anzahl der H3O+-Ionen sein muss.
- Die Anzahl der Hydroxid-Ionen aus der Autoprotolyse des Wassers kann vernachlässigt werden. Es gilt:
bzw. für Basen
- Für den pH-Wert einer Säure ergibt sich:
- Für den pH-Wert von Basen ergibt sich:
Schwache Protolyte (pK 4,5 - 9,5)
- Protolyte mit pK-Werten zwischen 4,5 und 9,5 liegen in wässriger Lösung nur noch zu einem geringen Teil in dissoziierter Form vor. Meist ist die Dissoziation so gering, dass angenommen werden kann, die Konzentration des undissoziierten Protolyten entspräche der Totalkonzentration.
- Damit ergibt sich für einwertige schwache Basen folgende Formel für den pH-Wert:
- Einwertige schwache Basen weisen folgenden pH-Wert auf:
Mehrwertige Protolyte
- Sind beide Protolysestufen sehr stark, z.B. im Ba(OH)2, so erfolgt die Berechnung wie bei den sehr starken Protolyten.
- Ist die erste Protolysestufe sehr stark, die zweite immer noch stark, z.B. H2SO4 so erfolgt die Berechnung des pH-Wertes bei verdünnten Lösungen wie bei zweiwertigen sehr starken Protolyten, in konzentrierten Lösungen wie bei einwertigen sehr starken Protolyten.
- Ist nur die erste Protolysestufe sehr stark, die weiteren schwach oder sehr schwach, wie z.B. bei H3PO4, so braucht bei Protolyten, deren pK-Werte der einzelnen Stufen um mindesten 5 Einheiten auseinander liegen, nur die erste sehr starke Stufe berücksichtigt werden. Die Berechnung erfolgt dann analog einer einwertigen starken Säure.